Arixtra (fondaparinux sodic): Defect important de calitate legat de acul seringii preumplute
Stimate profesionist din domeniul sănătății,
De comun acord cu Agenția Europeană pentru Medicamente și Agenția Națională a Medicamentului și a Dispozitivelor Medicale din România, compania VIATRIS HEALTHCARE LIMITED – IRLANDA dorește să vă informeze cu privire la următoarele:
Rezumat
- Viatris a primit rapoarte privind prezența unei culori maronii la nivelul acului seringii preumplute cu Arixtra și blocarea acestuia. Acest defect de calitate este legat de prezența unor particule străine de fier oxidat în interiorul acului.
- Deși este estimat ca fiind foarte rar, defectul poate apărea aleator în loturile distribuite în prezent pe piață, având un impact potențial asupra tuturor formelor de prezentare ale medicamentului Arixtra.
- Respectați următoarele precauții de manipulare înainte de a distribui sau administra Arixtra:
- Inspectați cu atenție toate seringile preumplute cu Arixtra pentru a detecta prezența culorii maronii la baza acului;
- Dacă baza acului seringii preumplute are o modificare de culoare (așa cum ilustrează figura 1), nu distribuiți și nu administrați Arixtra; returnați produsul la comerciant și/sau la compania Viatris pentru a fi înlocuit.
- Informați pacienții și aparținătorii cu privire la acest defect de calitate și la precauțiile de manipulare, incluzând necesitatea de a returna orice produs la care se observă defectul de calitate.
- Riscurile potențiale ale utilizării unei seringi preumplute care prezintă modificare de culoare includ lipsa eficacității din cauza blocării acului și reacții adverse în cazul administrării injecțiilor afectate. Aceste reacții pot consta în reacții de hipersensibilitate, complicații la locul injecției (inclusiv ruperea acului), reacții adverse tromboembolice și infecții sistemice.
Figura 1: Exemplu de seringă cu baza acului colorată
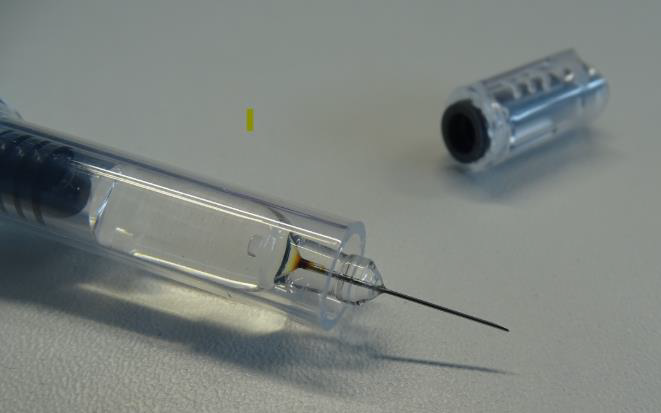
© 2025 Viatris
Informații suplimentare referitoare la problema de siguranță
În funcţie de concentraţie, medicamentul Arixtra este indicat pentru:
- Prevenţia evenimentelor tromboembolice venoase (ETV) la pacienţii supuşi unei intervenţii chirurgicale ortopedice majore la nivelul membrului inferior, cum sunt:
- Fractura de şold, inclusiv profilaxia prelungită
- Artroplastia de genunchi
- Artroplastia de şold
- Prevenţia evenimentelor tromboembolice venoase (ETV) la pacienţii supuşi unor intervenţii chirurgicale abominale care prezintă risc de complicaţii tromboembolice.
- Prevenţia evenimentelor tromboembolice venoase (ETV) la pacienţii cu afecţiuni medicale consideraţi a avea risc crescut de complicaţii tromboembolice ca urmare a mobilităţii restrânse datorită unor afecţiuni acute.
- Tratamentul trombozei venoase profunde (TVP) acute.
- Tratamentul emboliei pulmonare (EP) acute.
- Tratamentul sindromului coronarian acut reprezentat de angina instabilă sau infarctul miocardic acut fără supradenivelare de segment ST (UA/NSTEMI), pentru prevenirea decesului, a infarctului miocardic și a ischemiei refractare. S-a demonstrat că fondaparinux reduce mortalitatea de orice cauză la pacienții cu UA/NSTEMI.
- Tratamentul sindromului coronarian acut cu supradenivelare de segment ST (STEMI), pentru prevenirea decesului și a reinfarctului miocardic la pacienții tratați cu trombolitice sau la cei care, inițial, nu sunt candidați pentru alte forme de terapie de reperfuzie. S-a demonstrat că fondaparinux reduce mortalitatea de orice cauză la pacienții cu STEMI.
- Tratamentul trombozei acute simptomatice a venelor superficiale ale membrelor inferioare, în absența trombozei venoase profunde (TVP) concomitente.
Notă: Indicațiile aprobate la nivel local pot diferi,
Arixtra este autorizat în UE/SEE în următoarele forme de prezentare:
- Arixtra 1,5 mg/0,3 ml soluție injectabilă, seringă preumplută;
- Arixtra 2,5 mg/0,5 ml soluție injectabilă, seringă preumplută;
- Arixtra 5 mg/0,4 ml soluție injectabilă, seringă preumplută;
- Arixtra 7,5 mg/0,6 ml soluție injectabilă, seringă preumplută;
- Arixtra 10 mg/0,8 ml soluție injectabilă, seringă preumplută.
Până la această dată, investigația în curs de desfășurare privind procesul de fabricație arată că toate loturile au fost fabricate, ambalate și testate în conformitate cu Dosarul Autorizației de punere pe piață, respectând specificațiile înregistrate. Investigația continuă pentru identificarea cauzei principale și implementarea măsurilor corective/preventive adecvate.
Riscurile potențiale ale utilizării unei seringi preumplute care prezintă o modificare de culoare includ lipsa eficacității din cauza blocării acului și reacții adverse în cazul administrării injecțiilor afectate. Aceste reacții pot consta în reacții de hipersensibilitate, complicații la locul injecției (inclusiv ruperea acului), reacții adverse tromboembolice și infecții sistemice.
Apel la raportarea de reacții adverse
Este important să raportați orice reacție adversă suspectată sau eroare de medicație asociată cu administrarea medicamentului Arixtra (fondaparinux sodic) către Agenția Națională a Medicamentului și a Dispozitivelor Medicale din România, în conformitate cu sistemul național de raportare spontană, utilizând sistemul electronic de raportare/formularul de raportare disponibil pe pagina web a Agenției Naționale a Medicamentului și a Dispozitivelor Medicale din România (www.anm.ro), la secțiunea Medicamente de uz uman/Raportează o reacție adversă.
Agenția Națională a Medicamentului și a Dispozitivelor Medicale din România
Str. Aviator Sănătescu nr. 48, sector 1
București 011478- RO
Fax: +4 0213 163 497
e-mail: adr@anm.ro
website: www.anm.ro
Raportare online la adresa: https://adr.anm.ro/
Totodată, reacțiile adverse suspectate se pot raporta și către reprezentantul local al deținătorului autorizației de punere pe piață (DAPP) la următoarele date de contact:
Viatris / BGP Products S.R.L.
România Strada Gara Herastrau 2, Clădirea Equilibrium 1
Etaj 3, Sector 2, 020334, București, România
Tel : +40 372 579 000 ; Fax : +40 371 600 326
E-mail : pv.romania@viatris.com
Coordonatele de contact ale reprezentanţei locale a deţinătorului autorizaţiei de punere pe piaţă
Pentru întrebări şi informaţii suplimentare referitoare la utilizarea medicamentului Arixtra soluție injectabilă, seringă preumplută (fondaparinux sodic), vă rugăm să contactaţi Departamentul de Calitate al Companiei Viatris/ BGP Products S.R.L., la adresa de e-mail: complaints.ro@viatris.com.

