Comunicare directă către profesioniștii din domeniul sănătății. Vaxneuvance (vaccin pneumococic polizaharidic conjugat (15-valent, adsorbit)) suspensie injectabilă în seringă preumplută: Informații importante privind posibilitatea de spargere a seringilor preumplute Vaxneuvance
Stimate profesionist din domeniul sănătății,
De comun acord cu Agenția Europeană pentru Medicamente (EMA) și Agenția Națională a Medicamentului și a Dispozitivelor Medicale din România (ANMDMR), compania Merck Sharp & Dohme (MSD) dorește să vă informeze cu privire la următoarele:
Rezumat
- Pentru vaccinul Vaxneuvance suspensie injectabilă în seringă preumplută au fost raportate cazuri de spargere la nivelul flanșei și/sau butucului seringii, soldate cu lacerații sau răni prin înțepare cu acul.
- Investigații ulterioare au arătat că această situație este legată de o problemă identificată în procesul de fabricare al seringii. In timp ce au fost implementate acțiuni corective și preventive pentru a rezolva acest defect, toate seringile preumplute Vaxneuvance aflate în prezent pe piață pot prezenta acest defect potențial.
- Pentru a reduce riscul potențial de rănire a pacientului, personalului care asigură îngrijirea și/sau profesioniștilor din domeniul sănătății, li se recomandă să inspecteze cu atenție seringa de sticlă înainte de utilizare, iar doza să fie aruncată dacă se observă sau se suspectează spargerea seringii înainte de utilizarea Vaxneuvance.
- Dacă nu se observă niciun semn de spargere al seringii înainte de utilizare, în timpul preparării și administrării vaccinului, profesioniștii din domeniul sănătății trebuie să evite exercitarea unei forțe excesive asupra seringii (inclusiv asupra butucului seringii) atunci când elimină capacul sau 2 atașează acul la seringă, sau după administrare (de exemplu, la activarea mecanismului de siguranță pentru ac), precum și în timpul eliminării.
Informaţii suplimentare referitoare la problema de siguranţă
Vaxneuvance este disponibil sub formă de suspensie injectabilă în seringă preumplută. Compania MSD a primit rapoarte de spargere a flanșei și/sau butucului seringii care au fost identificate atunci când seringa a fost inspectată înainte de administrare, fie în timp ce profesionistul din domeniul sănătății atașa acul seringii, fie în timpul administrării vaccinului sau după administrare (de exemplu, la activarea mecanismului de siguranță pentru ac). Spargerea seringii a dus la un număr mic de răni care au fost raportate ca ușoare, ce au inclus plăgi lacerate și răni prin înțepare cu acul.
Investigația efectuată de MSD până în prezent a stabilit că spargerea este rezultatul unei etape din procesul de fabricare a seringilor care provoacă scăderea rezistenței sticlei și atunci când se aplică o forță ulterioară, are ca rezultat spargerea sticlei. Au fost implementate acțiuni la producătorul de seringi pentru a îmbunătăți procesele și pentru a preveni reapariția acestor defecte în loturile viitoare. Cu toate acestea, toate seringile preumplute Vaxneuvance aflate în prezent pe piață au potențialul de a prezenta aceste defecte, deoarece seringile au fost fabricate înainte ca furnizorul să implementeze măsurile corective.
Următoarele recomandări sunt propuse pentru a ajuta la identificarea seringilor sparte înainte de utilizare și pentru a reduce riscul de rănire. Vă rugăm să vă asigurați că personalul din instituția dumneavoastră implicat în administrarea Vaxneuvance urmează instrucțiunile disponibile în informațiile produsului și aceste instrucțiuni suplimentare detaliate mai jos:
Înainte de utilizare
- Compania MSD recomandă inspectarea seringii pentru a verifica dacă aceasta este spartă în timp ce se află în ambalaj și după scoaterea din acesta.
- Dacă se observă sau se suspectează spargerea seringii, vă rugăm să o aruncați și să nu încercați să administrați doza din seringa respectivă.
În timpul pregătirii și administrării vaccinului
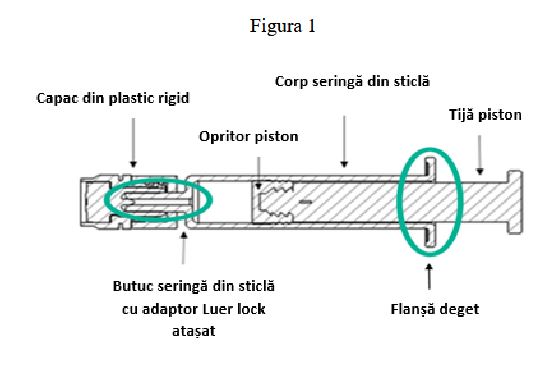
- Dacă nu se observă niciun semn de spargere al seringii, continuați cu administrarea dozei. Evitați exercitarea unei forțe excesive asupra seringii, inclusiv asupra butucului seringii, fie atunci când scoateți capacul, sau când atașați acul la seringă sau după administrare (de exemplu, când activați mecanismul de siguranță al acului) și în timpul eliminării (Figura 1).
Apel la raportarea de reacții adverse
Este important să raportaţi orice reacţie adversă suspectată și/sau problemă de calitate asociată cu administrarea Vaxneuvance către Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale din România, în conformitate cu sistemul naţional de raportare spontană, utilizând formularele de raportare disponibile pe pagina web a Agenţiei Naţionale a Medicamentului şi a Dispozitivelor Medicale din România (www.anm.ro), la secţiunea Medicamente de uz uman/Raportează o reacţie adversă.
Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale din România
Str. Mr. Stefan Sanatescu nr. 48, sector 1
Bucureşti 011478 - RO
Fax: +4 0213 163 497
e-mail: adr@anm.ro
https://adr.anm.ro/
Conform rezumatului caracteristicilor produsului aprobat:
- Pentru a avea sub control trasabilitatea medicamentelor biologice, numele și numărul lotului medicamentului administrat trebuie înregistrate cu atenție.
- Vaxneuvance face obiectul unei monitorizări suplimentare. Acest lucru va permite identificarea rapidă de noi informaţii referitoare la siguranţă. Profesioniştii din domeniul sănătăţii sunt rugaţi să raporteze orice reacţii adverse suspectate.
Totodată, reacţiile adverse suspectate se pot raporta şi către deţinătorul autorizaţiei de punere pe piaţă, la următoarele date de contact:
Coordonatele de contact ale reprezentantului local al Deținătorului de autorizație de punere pe piață:
Merck Sharp & Dohme România S.R.L
Bulevardul Poligrafiei, Nr. 1A, Etaj 5, Sectorul 1, Bucureşti, România
E-mail: dpoc.romania@merck.com
Tel: +4 021 529 29 00; Fax: +4 021 318 52 36
Cu stimă,
Dr. Simona Stancu
Director Medical
MSD Romania SRL

